成功的商业故事,自然令人欣喜。但其实,盛极而衰的事件背后的逻辑,更值得回味。
相比传统制药,k8凯发首页登录微生物制药从早期开发、临床试验到商业化应用,整个过程都差异很大。一直以来,肠道微生物都被作为部分疾病后期解决方案中的一种。此前,FDA曾根据一项独特的“执行自由裁量权”政策,允许粪菌移植(FMT)在未经批准的情况下进行。
转折出现在2012年,FDA设立了一个新的产品类别,即活性生物治疗产品(LBP),用于微生物药物审批。由此点燃了微生物药物的开发和投资热潮。2022年,全球*微生物药物获批上市。到2023年末,全球已经有3款微生物药物获批上市。
不过,明星药企的大溃退,也出现在行业曙光刚刚亮起的2022年前后。裁员、退市、合作的管线被退回,甚至直接解散团队。菌群制药的前景,似乎乌云密布。在本文中,我们尝试找到最容易击垮微生物制药企业的风险点,让仍然奋战在微生物药物开发一线的企业,尽可能绕开。
没有试错空间
如果时光一定要往回倒,微生物制药领域明星企业的这种溃退迹象,早在2019年就开始出现。在全球资本大举入局的2019年,微生态制药明星企业Seres Therapeutics解雇了30%的员工,重新聚焦核心管线的临床推进。后来,随着越来越多的管线进入临床试验的中后期,微生物制药企业的经营风险也更大。
实际上,简单梳理困境之中的微生物药企过去几年的研发投入和临床成绩会发现,临床试验难以推进的背后,原因往往十分唏嘘。
一方面,作为开发创新生物技术的初创企业,微生物制药企业在临床试验策略上缺少经验,需要相对宽松的试错空间,用失败来换成功的可能。11月末刚刚全员解散的Evelo Biosciences是典型的反面案例。在外界的解读中,几条自研核心管线EDP1867、EDP1815、EDP2393的临床试验陆续失败,Evelo难以为继,只能解散。但其实,一直到最后,EDP1815都保持了治疗银屑病优异的安全性、有效性数据,EDP2393的长期数据也打败了对照组。从某种意义上讲,Evelo错在了把有限的流动性给到错误的适应症。
11月20日,Evelo董事会向美国证券交易委员会提交了其注销计划,结束了近10年的经营。2014年,在Flagship Pioneering的孵化下,Evelo正式成立,专注于开发治疗免疫疾病的口服微生态药物,用单一微生物菌株构成的药物制剂,来上调或下调免疫途径的功能。2018年,Evelo登陆纳斯达克市场,募得8500万美元资金,市值一度达到20亿美元。在此之前,梅奥诊所、GV、Celgene等一众*机构和企业参与投资,Evelo成为相当亮眼的微生物制药明星企业。
*被Evelo放弃的,是EDP1867。2022年4月,EDP1867用于治疗特应性皮炎的Ⅰ期临床试验宣告失败。在接受低剂量药物EDP1867的15名患者中,8周后没有明确证据显示该药物有益处,EDP1867被搁置。
当Evelo集中力量开发EDP1815和EDP2393时,策略逐渐走偏。外界对于EDP1815最广泛的认知,是治疗特应性皮炎的有效性不及安慰剂。今年2月,EDP1815用于特应性皮炎的Ⅱ期临床试验,未能达到主要终点。根据试验结果,对照组(安慰剂组)的EASI-50(即特应性皮炎病情评分改善50%)为56%,而EDP1815组在队列1、2和3中,仅有分别41%、38%和32%的患者在第16周实现EASI-50及以上应答,有效性都不及安慰剂。
在当时,Evelo判断问题出现在,安慰剂过于有效。遗憾的是,经过重新审查,在2023年4月公布的临床试验数据中,EDP1815的表现仍不敌安慰剂。在队列4中,有37.9%的EDP1815组患者在第16周实现了EASI-50及以上应答,而安慰剂组为44.7%。
有意思的是,EDP1815在更早前的银屑病II期试验中,已经有了不俗的表现。按照Evelo的计划,他们会推进EDP1815的开发,以广泛治疗选择很少的轻度和中度疾病的银屑病患者。但不知为何,Evelo并没有集中火力做EDP1815治疗银屑病的III期临床试验。在银屑病方面,Evelo押注的实际上是EDP2393。今年3月,Evelo曾收到纳斯达克的退市警告。当时Evelo的CEO Simba Gill 博士表示,将把资源集中到基于其下一代细胞外囊泡平台的*候选药物EDP2939项目上来。
遗憾的是,10月出炉的EDP2939治疗银屑病的Ⅱ期临床试验数据,仍然不理想。该研究的主要终点,即在每日治疗16周后,EDP2939和安慰剂之间的银屑病面积和严重程度指数(PASI)评分(PASI-50反应)较基线改善 50%的患者比例差异未实现。但值得注意的是,该数字比例从第16周时低于安慰剂(EDP2939组19.6% vs 安慰剂组25%)到第20周随访时优于安慰剂组(EDP2939组 33.9% vs 安慰剂组26.9%)。换言之,如果方案设计合理,EDP2939的临床试验失败,或许可以避免。
这时,Evelo又尝试调转车头,准备放弃EDP2939,重拾EDP1815。Simba Gill博士表示,“虽然我们对EDP2939的II期研究结果感到失望,但我们仍然相信我们的小肠轴(SINTAX)平台的价值以及我们的潜在产品EDP1815。我们之前在一项针对轻度至中度银屑病伴EDP1815的2期研究中报告了积极的疗效和安全性数据。鉴于这项研究的结果,我们将停止开发EDP2939,并正在审查潜在的战略替代方案,包括寻求与EDP1815和SINTAX平台合作。“
在创新药投融资鼎盛时期,只要临床价值有足够的数据支撑,策略的失败并不足以致命。如今的临床试验,却多少有点孤注一掷的意味。此前,Evelo尝试用裁员的方式,来缓解资金压力。2023年1月,Evelo裁员比例达45%,第二季度进一步裁员。但对于创新药企而言,节流属于远水救不了近火。
外部资金枯竭
另一方面,在资金需求*的临床试验阶段,两条可能的外部融资渠道,同时收紧,让微生物制药企业一时间失去了试错机会。股权融资方面,流向生物科技的资金总量明显缩水。BioWorld数据显示,2020年以来,全球创新药领域的投融资迅速降温。从融资总额看,2022年全球创新药企业共吸纳608亿美元融资,相比2020年高位时的1345亿美元,只剩不到一半。与此同时,2023年上半年,二级市场的XBI指数在标普500指数上涨15.9%期间,逆势下跌。在这个过程中,包括微生物制药企业在内的大量生物科技初创公司都收到了退市警告。
2022年6月,另一家微生物制药的明星企业4D pharma从纳斯达克股票市场退市。从公开资料看,4D pharma并没有重大过失,在研产品的临床试验也顺利推进,除了融资困难,很难找到其他衰退原因。4D pharma是活体生物治疗药物开发领域的全球*,同样原则基于口服给药的单一细菌菌株来治疗各种疾病。
资料显示,4D pharma同时铺开了6个临床项目,分别是MRx0518联合可瑞达 (帕博利珠单抗)治疗实体瘤的I/II期研究、MRx0518联合BAVENCIO (avelumab)治疗尿路上皮癌一线维持治疗的II期临床试验、MRx0518在实体瘤患者新辅助治疗中的I期研究、MRx0518治疗胰腺癌患者的I期研究、MRx-4DP0004治疗哮喘的I/II期研究,现金流压力可见一斑。
其中,就在退市3个月前的2022年3月,该公司基于微生物组的在研疗法MRx0518与抗PD-1抗体Keytruda联用,在治疗肾细胞癌的1/2期临床试验中达到主要疗效终点。但是在投资者决策阈值提高了许多的当下,这样的临床进展,俨然很难吸引到足够的外部资金。
对于生物科技初创企业而言,权限授权无疑是重要的资金来源。微生物制药的早期兴起,也离不开跨国药企的重金布局。不过,近年来,跨国药企对于微生物制药的热情,已经明显衰减。据stifel统计,2023年,全球管线授权市场保持了与上年几乎一致的并购节奏,但位列前三的适应症中,微生物制药企业重点布局的皮肤、胃肠系统疾病,并不在其列。
实际上,跨国药企关于微生物制药的态度,不但不再激进,反而开始撤退。2022年8月,在充分审视自身产品策略后,武田制药决定解除与Finch Therapeutics在FIN-524和FIN-525之上的合作。随后不久,Finch也终止了核心产品CP101的III期临床试验,持续经营风险显现。
2022年8月,在开始裁员3个月后,Kaleido没能找到合适的交易机会,停止了所有研发,这家由Flagship的微生物制药企业,进入破产阶段。然而,就在大半年以前,Kaleido的首席执行官Daniel Menichella还向媒体透露,将有望在2022年上半年开始溃疡性结肠炎的II期研究。
Kaleido成立于2017年,由Flagship出资6500万美元,并于2019年上市。该公司已与强生的杨森(Janssen)和MD安德森癌症中心(MD Anderson Cancer Center)签署了合作协议。2022年1月,Kaleido曾被曝裁员,随后暂停了KB109的II期临床试验。但就在这个消息发布前几周,强生旗下杨森生物技术公司扩大了与Kaleido的研究合作,以寻求特应性、免疫和代谢疾病的治疗。
失去了宽松的外部资金环境,一款新药商业化的难度,无疑大了许多。
微生物新药
走完了商业化的闭环
当然,抛开临床开发的困境,微生物药物的市场需求明确。
2023年4月,Seres Therapeutics的SER-109获批上市,商品名VOWST,用于治疗复发性的艰难梭菌感染。VOWST是全球*款做成口服制剂的微生物药物,含有一种被称为厚壁菌门的有益肠道细菌,它的商业化将由Seres和雀巢共同完成,双方将平分VOWST的销售收入。
作为一款临床新药,VOWST一上市就取得了亮眼的市场反馈。根据Seres公布的最新财报,VOWST获批后,自2023年6月开始在美国上市,到9月末,已经收到610份填写完整的处方登记表。其中,有282名患者已开始接受VOWST的治疗。此外,VOWST暂时还没有纳入商业保险,这些处方登记表由480多家不同的医疗保健提供者提交,有78名医疗保健提供者已经已向超过一名患者开出VOWST。
值得注意的是,VOWST的定价并不低,并且除了VOWST外,临床上用于艰难梭菌治疗,还有其他方案。艰难梭菌是一种常见于健康肠道微生物群中的细菌。当某人服用抗生素时,可能会改变肠道微生物的平衡,并导致危及生命的艰难梭菌感染(CDI)。即使它们被清除,由于肠道菌群不平衡,感染也可能多次复发。
目前,临床上最常见的艰难梭菌感染治疗方案是粪菌移植,但这种治疗方式的体验感非常差,人们一直尝试开发新的治疗方案。除了VOWST外,生物制剂贝罗妥昔单抗、灌肠剂REBYOTA都是近年出现的新疗法。其中,REBYOTA在2022年上市,是全球第二款获批的微生物药物,它也需要从健康捐赠者身上采集肠道微生物样本,与传统的粪便微生物移植不同之处在于,REBYOTA的制备过程中涉及严格的指控流程,来确保微生物治疗的稳定性。
现阶段,由于上市时长都不长,还没有直接将VOWST与上述替代方案进行比较的研究数据。但从数据的交叉对比看,VOWST的有效性在REBYOTA和贝罗妥昔单抗之上,在粪菌移植之下,治疗成本是4类方案中最高,但用药途径最为友好。相对较好的疗效和便捷的口服剂型,或许正是VOWST大受欢迎的原因。
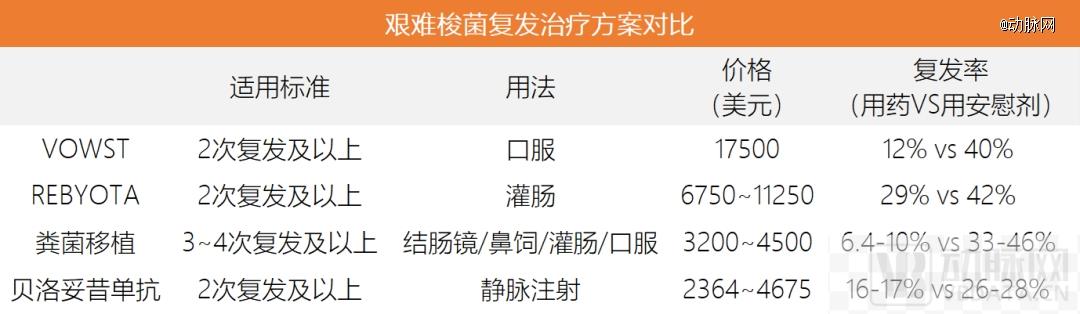
复发性艰难梭菌感染的治疗方案对比
在这份财报中,Seres也承认,VOWST是一款很棒的产品,但由于价格非常高,商业化前景不明朗。从控费的角度看,商业保险计划可能仅将VOWST作为第二线方案,即在更便宜的替代方案失败后使用。如果不考虑价格因素,VOWST很容易成为医生和患者预防复发性艰难梭菌感染的**线选择。当然,Seres也在尝试降低VOWST的商业化使用成本。2023年8月,Seres关闭了3处捐献者采集中心中的一个,并设立捐献者筛选实验室,来降低成本。
从某种意义上讲,过去10年间,上百场临床试验下来,微生物制药快速验证了临床价值。眼下,微生物制药被卡在了商业价值之上。当近一半的海外微生物制药明星企业相继倒下,人们不禁为这个行业捏把汗。但颗粒度更细的观察结果,是这个行业仍有下蹲再起跳的机会。我们仍然希望看到,当试错空间和资金环境变得适当宽松后,可有更多的微生物新药来解决复杂的临床难题。


